导读
铝工业的可持续性发展面临铝土矿尾矿和赤泥处置问题的挑战。我们先前的研究表明,将铝土矿尾矿和赤泥作为类土壤基质(BRM)进行处置,在采用适宜的先锋物种后,能够通过促进BRM的土壤形成过程,在铝土矿开采后的植被恢复中展现出巨大的应用潜力。本研究评估了六种先锋植物(青葙、地肤、碱蓬、草木樨、苏丹草和田菁)对BRM理化性质和微生物组的改良效果。结果表明,先锋植物显著降低了BRM的盐碱度,同时增加了微孔体积、有效磷和有机质含量(p < 0.05)。此外,种植先锋植物后,BRM中微生物多样性和网络稳定性显著提升。偏最小二乘路径模型分析显示,孔隙结构改善是植物促进BRM土壤形成过程中最重要的因素。尽管六种植物在BRM中均生长良好,但青葙的地上部生物量和根系体积最大。与其他植物相比,青葙显著增加了BRM的微孔体积。而草木樨在调节BRM盐碱度方面表现出更强的能力,导致嗜盐细菌丰度更显著降低。基于灰色关联分析的综合评价表明,青葙和草木樨是适合在BRM处置区进行植被恢复的先锋植物。
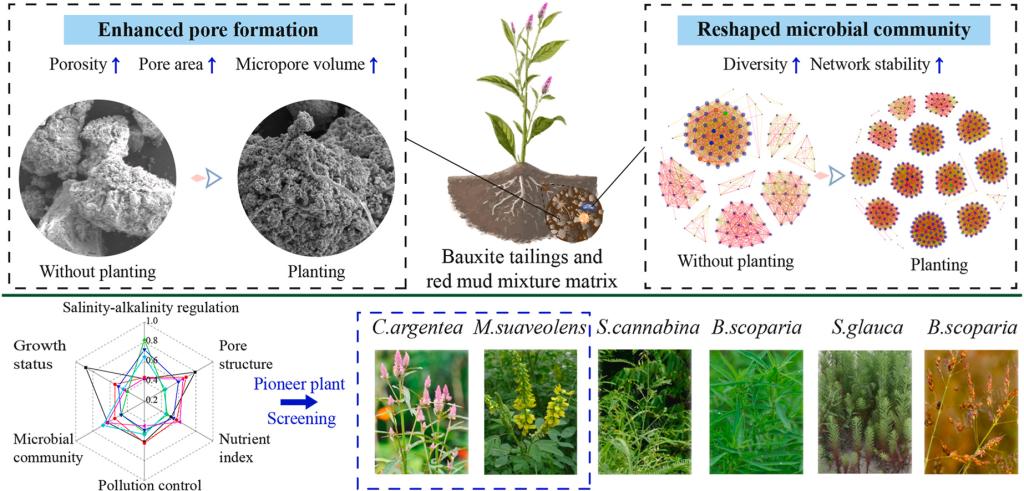
图文摘要
论文ID
原名:Pioneer plants promote soil formation in a mixture of bauxite tailings andred mud
译名:先锋植物促进铝土矿尾矿和赤泥混合物中的土壤形成
期刊:Journal of Environmental Management
IF:8
发表时间:2024.9
通讯作者:刘杰
通讯作者单位:桂林理工大学环境科学与工程学院
DOI号:10.1016/j.jenvman.2024.122590
结果
1.植物在BRM中的生长
本实验选定的六种植物(青葙、地肤、碱蓬、草木樨、苏丹草和田菁)经过30天的生长,均能在BRM中正常萌发并良好生长(图S1)。植物根系发育良好,叶片呈现健康绿色,表明六种植物对盐碱贫瘠环境具有良好耐受性。然而,六种植物的生长状态存在差异,其株高在90天生长期内变化显著,最终达到23.9–55.4厘米(图1a)。其中,青葙的地上部生物量(18.3g/盆)和叶片生物量(9.29g/盆)最高。此外,青葙地上部的C/N最高,其叶片的叶绿素和类胡萝卜素含量也显著高于其他植物(图S2和图S3)。碱蓬地上部生物量以16.2g/盆位居第二(图1b),但其根系生物量最低(1.06g/盆),根系面积仅为124平方厘米(图1c),且丙二醛含量为六种植物中最高。值得注意的是,青葙的根系体积(50.3 cm³)和根系活性(411ug TTF/g·h)在六种植物中表现最优(图1e)。
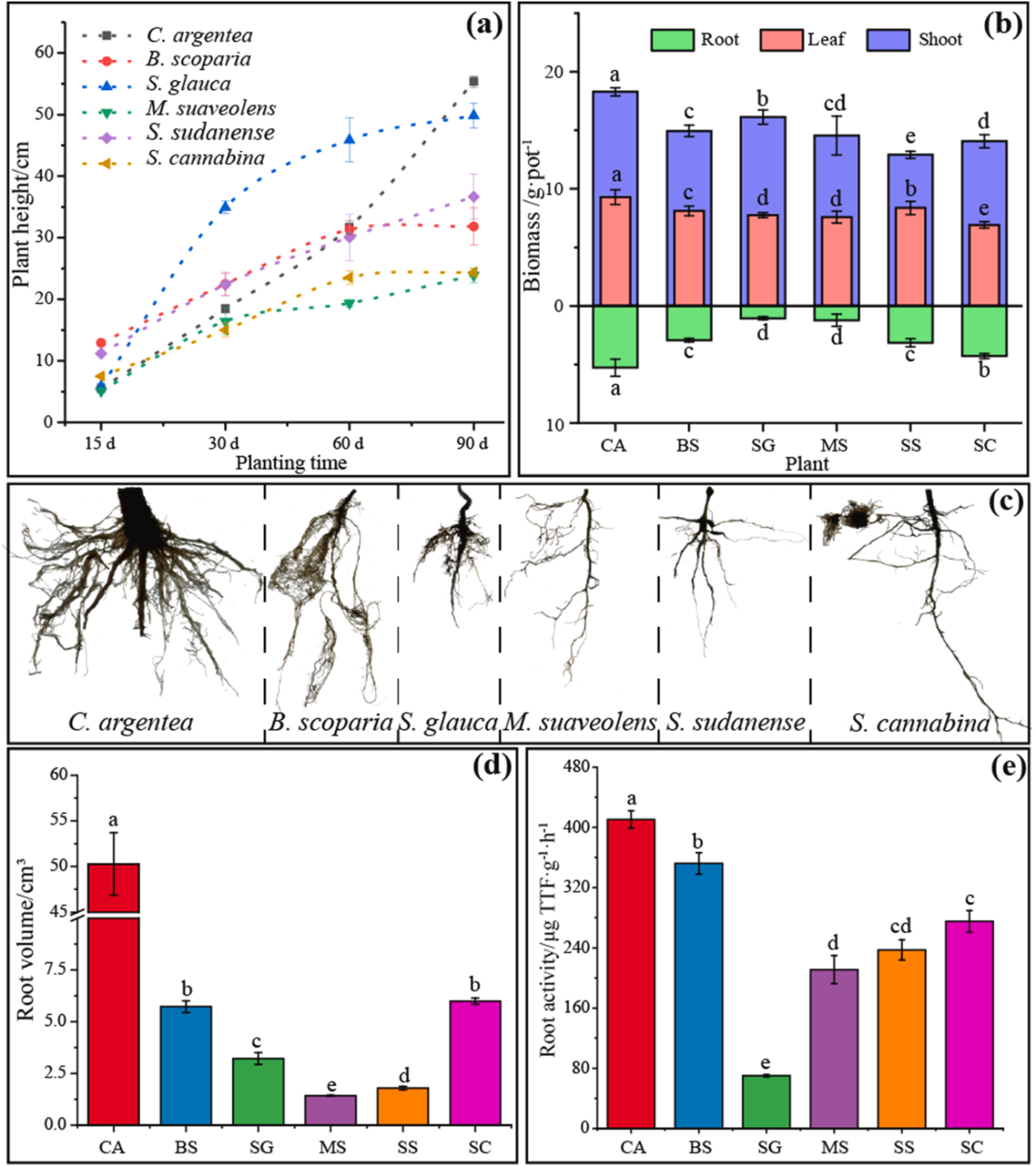
图1. 六种先锋植物在BRM上的生长情况。(a)实验期间植株高度的变化;(b)植物生物量;(c)90天后的根系形态;(d)根体积;(e)根系活性。注:CA为青葙(C. argentea);BS为地肤(B. scoparia);SG为碱蓬(S. glauca);MS为草木樨(M. suaveolens);SS为苏丹草(S. sudanense);SC为田菁(S. cannabina)。柱状图上方的字母表示根据LSD检验(p < 0.05)各均值间的显著性差异。
2.植物对BRM孔结构的影响
本实验的六种植物种植后,BRM的孔隙率、平均孔径和孔隙面积均显著增加(p < 0.05),颗粒密度降低(表1)。此外,BRM的总孔隙体积增加了251–488%(图2),其增幅按碱蓬<草木樨<苏丹草<地肤<田菁<青葙的顺序增加。隐孔隙(Crytopore)体积从1.17 cm³/g增至3.89–5.60 cm³/g,微孔体积从0.05 cm³/g增至0.25–0.88 cm³/g。其中,青葙使BRM的微孔体积增加了16.6倍。 表1 不同植物对BRM孔隙特性的影响
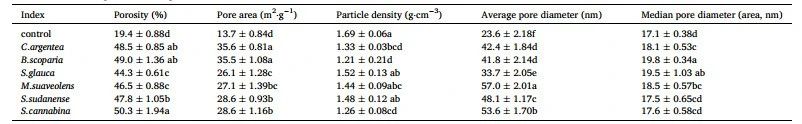
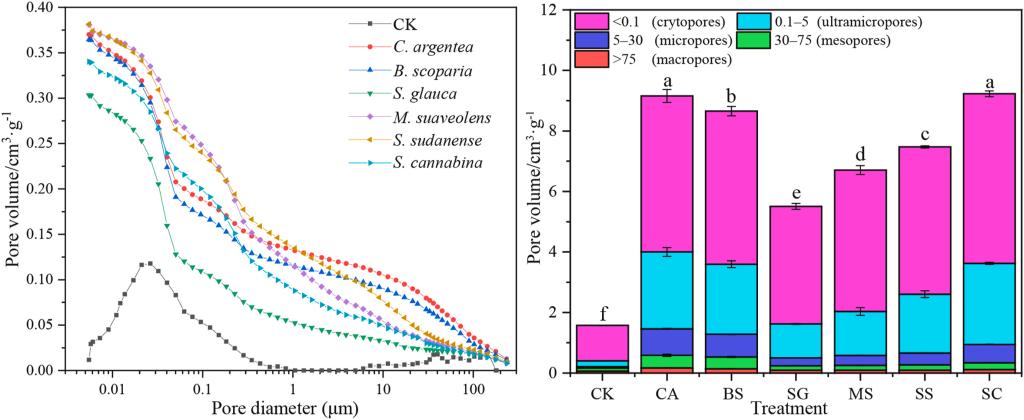
图2.不同植物对BRM孔隙结构的影响
3.植物对BRM盐度和碱度的影响
未种植BRM的pH值从8.14(15天)下降至8.01(90天),而电导率(EC)从1155 μS/cm上升至1350 μS/cm(图3b)。然而,随着种植时间延长,pH和EC呈现波动性下降趋势。与未种植土壤相比,种植90天后BRM的pH降低了2.43–8.80%,EC降低了18.6–33.2%。其中,种植碱蓬(S. glauca)使BRM的pH降至7.31,种植草木樨(M. suaveolens)使EC降至902 μS/cm。此外,BRM的交换性钠含量在种植后显著下降53.8–214%(p < 0.05),其中碱蓬和草木樨分别将交换性钠含量降低至531 mg/kg和547 mg/kg(图3c)。值得注意的是,生长90天后,碱蓬和草木樨的地上部钠积累量分别达到153 mg/盆和140 mg/盆(图3d)。
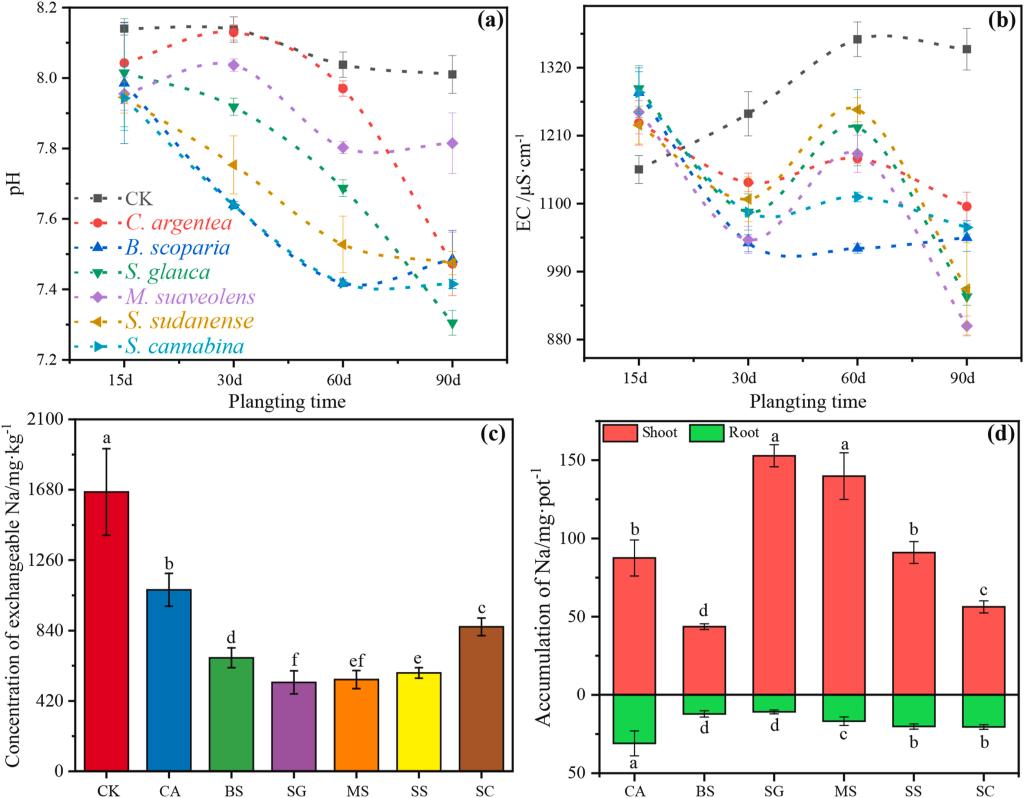
图3.植物对BRM的pH值(a)、电导率(B)、交换性钠(c)和植物中钠积累的影响(d)
4.植物对BRM矿物相及有毒元素的影响
BRM的碱性矿物相组成主要包括方钠石、方解石、钙霞石和铝酸三钙(图S4)。种植先锋植物的BRM与未种植的BRM相比,其X射线衍射图谱显示钙霞石和方钠石的特征峰强度降低,表明这两种矿物在BRM中的含量减少。其中,碱蓬(S. glauca)、苏丹草(S. sudanense)和草木樨(M. suaveolens)对钙霞石和方钠石的降低作用较其他植物更显著。此外,种植先锋植物显著增强了高岭石的特征峰强度,并形成了新矿物相——蒙脱石。图4中BRM的SEM显示植物根系已深入BRM颗粒内部。元素面扫分析表明,种植使BRM颗粒表面的Na含量从11.4%降至1.19–10.3%,证实了碱性矿物相的减少;而Al含量则从15.9%增至18.2–69.0%(青葙(C. argentea)除外,其Al含量为14.3%)。特别值得注意的是,草木樨使BRM颗粒表面的Na含量降低了319%,同时使Al含量增加了334%。

图4.植物对BRM形态和表面元素的影响 BRM中所有有效态有毒元素含量均低于10 mg/kg,其中Cd、Cr和As含量低于0.20 mg/kg(图S5)。种植显著降低了BRM中有效态Cd含量,而As含量未发生显著变化。种植草木樨(M. suaveolens)显著增加了BRM中交换态Al和有效态Pb含量,而Hg和Pb则显著降低(p < 0.05)。此外,青葙(C. argentea)显著降低了交换态Al和有效态Pb含量。
5.植物对BRM养分和酶活性的影响
种植植物后,BRM的土壤有机质(SOM)、总氮(TN)、有效态N、P、K及阳离子交换量均发生改变(图S6)。种植显著增加了BRM的SOM含量,同时显著降低了有效态K含量(p < 0.05)。具体而言,地肤(B. scoparia)将BRM的SOM含量提升至最高值9.05 mg/kg,其次是草木樨(M. suaveolens)的8.86 mg/kg。此外,田菁(S. cannabina)使BRM的TN含量从0.44显著增加至0.50 mg/kg。草木樨和田菁显著增加了有效态N含量,而其他植物则降低了该含量。种植青葙(C. argentea)、地肤和田菁显著提高了BRM的阳离子交换量,而种植碱蓬(S. glauca)和草木樨则显著降低了该指标。与对照相比,青葙使有效态P含量显著增加17.3倍,并显著提高了BRM的碱性磷酸酶活性(图S7)。种植显著增强了BRM的脲酶和蔗糖酶活性(p < 0.05),其中田菁的脲酶和蔗糖酶活性最高。
6.植物对BRM微生物的影响
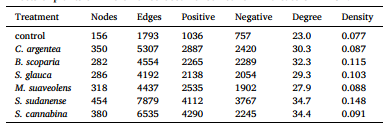
本研究结果显示种植显著增加了BRM中细菌的Chao1丰富度指数和Shannon多样性指数(p < 0.05,图S8)。此外,种植后真菌的Shannon指数提高了26.8–183%。青葙(C. argentea)使BRM中细菌的Chao1指数和Shannon指数分别达到最高值1321和8.35。非度量多维尺度分析表明,种植显著改变了微生物组结构(图S9)。种植后,BRM中优势菌属(如Sphingopyxis、Devosia、Neocosmospora和Sediminibacterium)的丰度均有所增加(图S10)。然而,Membranicola、Cladosporium、Pseudallescheria、Penicillium、Scedosporium和Pedosphaeraceae的丰度在种植后下降。 DESeq2分析鉴定出88个微生物属在种植后丰度发生显著变化,其中33个属减少,55个属增加(图S11)。这些微生物包括嗜盐细菌(Methanoculleus)、病原微生物(Rhizoctonia)和植物根际促生菌(PGPR,如Mesorhizobium)。为进一步研究嗜盐细菌、病原微生物及PGPR的变化,我们比较了它们在不同BRM中的相对丰度(前60%)(图S12)。种植显著降低了BRM中嗜盐细菌(如Planomicrobium、Methanoculleus、Methanosarcina和Halobacillus)的相对丰度。其中,种植草木樨(M. suaveolens)和碱蓬(S. glauca)使Halobacillus丰度分别降低2.45倍和1.58倍。病原微生物(Rhizoctonia和Ralstonia)的相对丰度在种植后也显著下降。然而,不同PGPR的丰度在种植后显著增加(p < 0.05)。例如,种植青葙(C. argentea)和地肤(B. scoparia)使Bacillus丰度分别增加1.02倍和1.72倍;种植草木樨(M. suaveolens)和田菁(S. cannabina)后,Rhizobium丰度分别增加342%和273%。 本研究结果显示种植显著影响了微生物网络的复杂性和稳定性(表2)。与对照相比,种植增加了网络复杂性,包括网络平均度数、节点数和网络密度。种植后,BRM的网络节点数从156增加至282–454,平均度数从23.0提升至27.9–34.7。在BRM微生物网络中,细菌占主导地位(84.0–92.1%),而真菌次之(6.39–13.8%)(图5)。苏丹草(S. sudanense)使平均度数和网络密度分别达到最高值34.7和0.15。不同植物导致微生物网络的关键物种不同。例如,Mesorhizobium和Nitrosospira是草木樨(M. suaveolens)和田菁(S. cannabina)种植的BRM中的关键物种,而Bacillus是青葙(C. argentea)种植的BRM中的关键物种。此外,Rhizaria是碱蓬(S. glauca)和田菁种植后微生物网络中的关键物种。
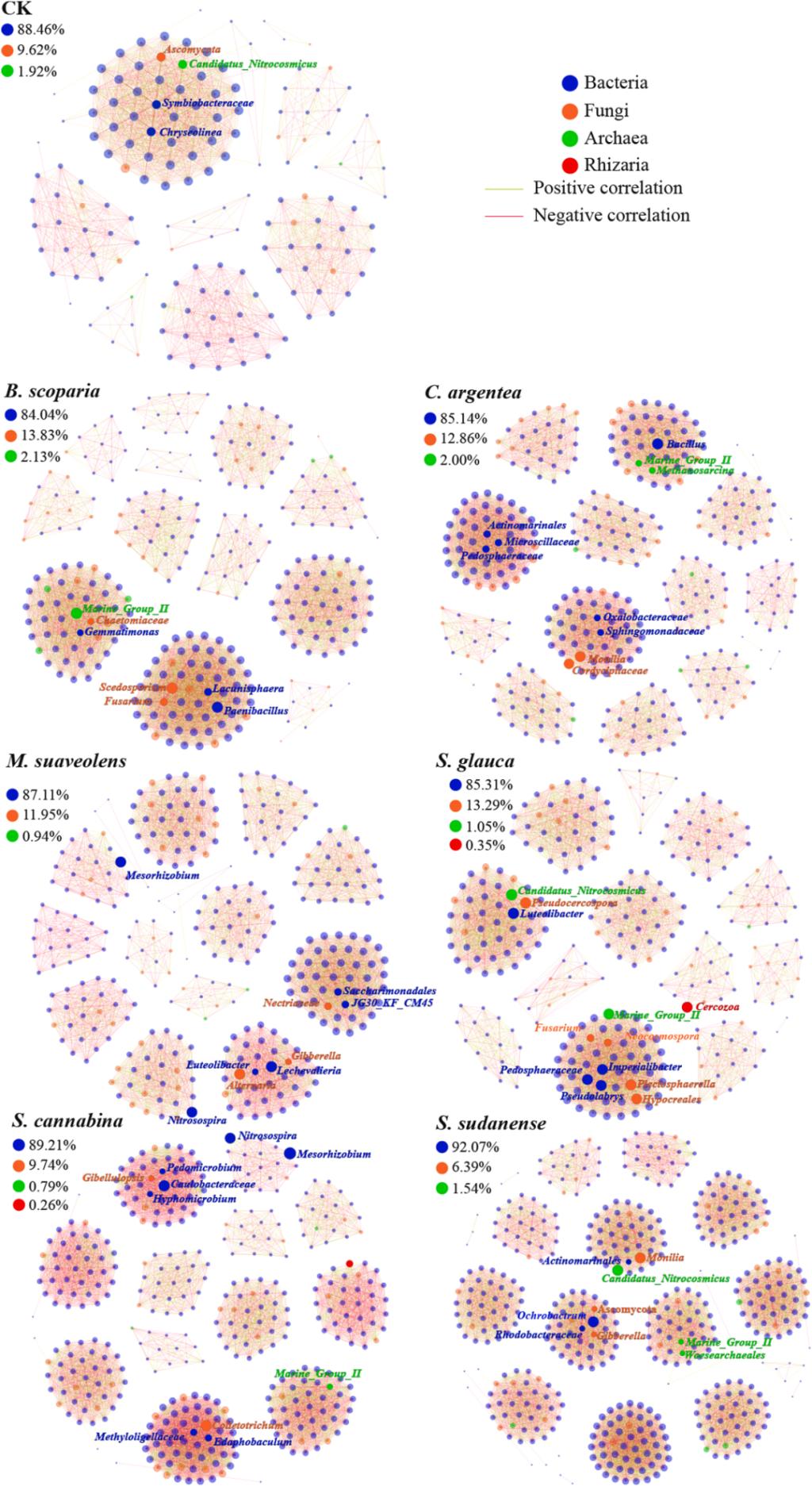
图5. BRM中的微生物共生网络
表2 植物对BRM中微生物共现网络指标的影响
7.植物效应的偏最小二乘路径分析
本研究采用PLS-PM分析了植物生长对BRM理化性质和微生物组的直接及间接影响(图6)。植物生长显著影响孔隙结构(p < 0.05),参数间呈现中等正相关性(r = 0.56)。此外,植物生长与微生物组呈弱正相关(r = 0.21),但与盐碱度(r = −0.15)及污染指标(r = −0.45)呈负相关。孔隙结构对养分、盐碱度和微生物组的影响系数分别为0.60、−0.75和0.69。
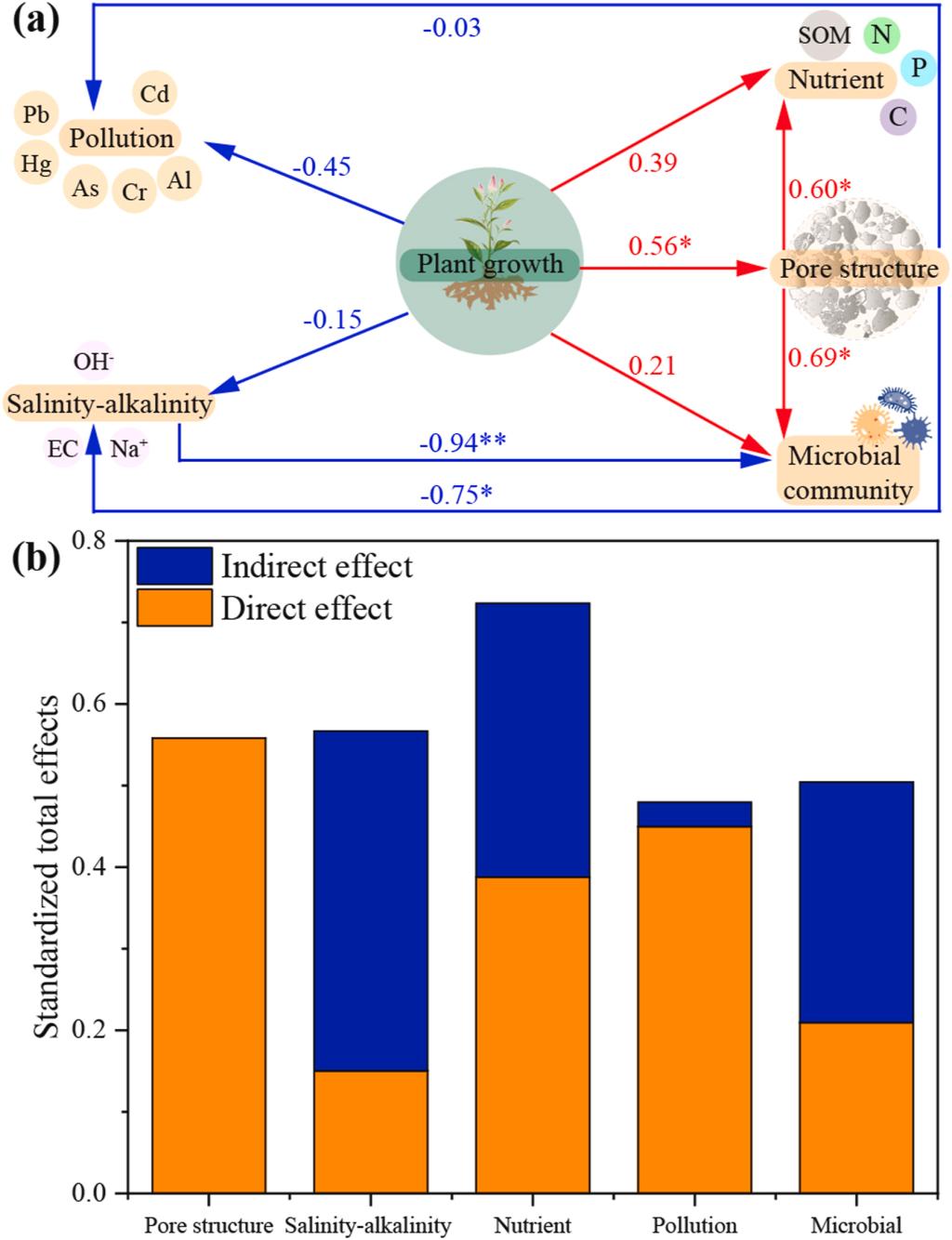
图6. 基于偏最小二乘路径模型分析的植物改良BRM理化性质及微生物群落的潜在机制。(a)植物对理化性质及微生物群落的直接与间接效应;(b)各预测变量的标准化总效应。红色与蓝色数值分别表示正向和负向路径系数(*表示p < 0.05;**表示p < 0.01)。
8.先锋植物综合评价
GRA分析表明,青葙(C. argentea)是改良效果最佳的植物,其改善BRM孔隙结构的能力最强且具有优异的污染控制能力(图7a)。六种植物中,碱蓬(S. glauca)和草木樨(M. suaveolens)对BRM盐碱度的调控能力更高,而苏丹草(S. sudanense)更利于微生物组发展。青葙的总评分最高(3.86),其次为地肤(B. scoparia,3.42)和草木樨(3.32)。为增强植物对BRM的改良效果,我们设想青葙可与其他植物组合种植(图7b)。结果显示,青葙与草木樨组合种植的评分最高(4.17)。
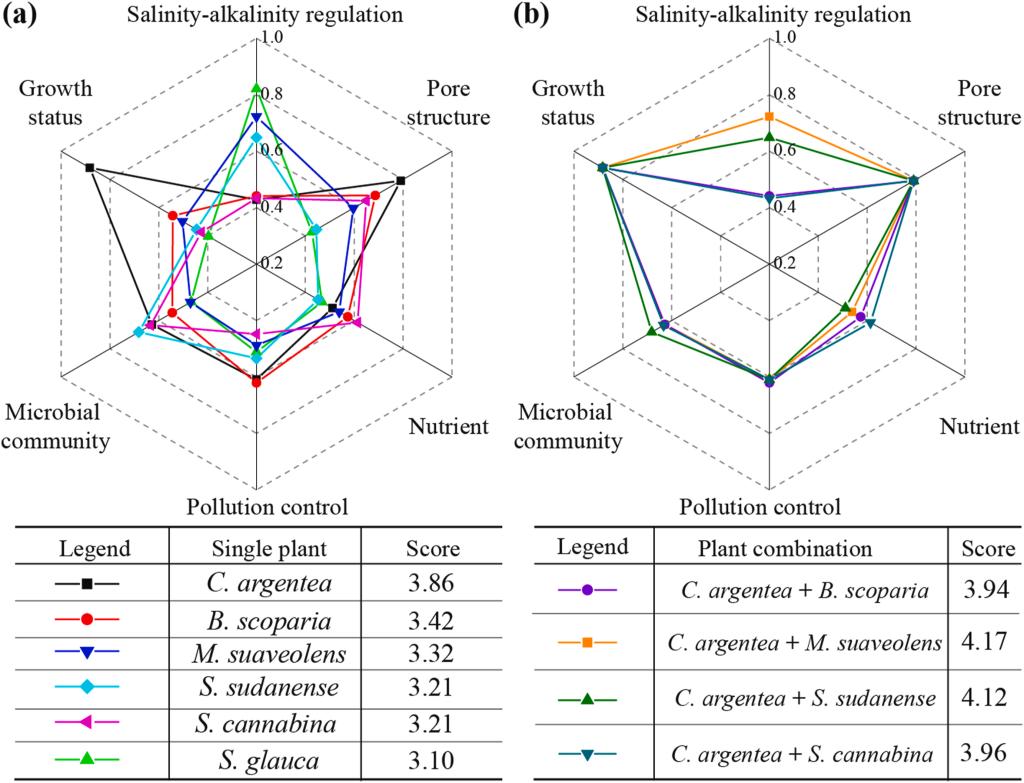
图7.植物生长状况与植物对BRM改善效果的灰色关联分析。(a)单株,(B)植物组合
讨论
1.植物促进BRM形成
铝土矿尾矿和赤泥因缺乏孔隙导致导水性差且易硬化。我们先前研究发现,赤泥与铝土矿尾矿混合可促进大团聚体形成,从而产生大孔隙。微孔隙(5–30 μm)在土壤基质中同样至关重要,如参与物质传输和土壤生物交换。然而,由于铝土矿尾矿和赤泥均为黏土类固体废弃物,BRM中微孔隙的形成具有挑战性。本研究发现,种植植物后,BRM的孔隙率、孔体积和孔面积显著增加(p < 0.05;表1),微孔体积(5–30 μm)从0.01 cm³/g增至0.25–0.88 cm³/g(图2)。SEM图像显示,这些微孔隙由直径5–17 μm的根毛穿透形成。此外,种植后BRM的隐孔隙体积显著增加(图2),这些隐孔隙可能是根系生长挤压基质颗粒导致爆裂形成。植物根毛分泌的不溶性高分子化合物(如多糖、蛋白质、碳水化合物等)能将黏土颗粒黏结,从而增强微孔隙稳定性。BRM的高方解石含量使根毛衰亡后孔隙内壁能被碳酸盐胶结物良好覆盖,确保微孔隙在失去根系支撑后仍保持完整。
PLS-PM分析表明,植物通过改善BRM孔隙结构驱动盐碱度降低、养分提升和微生物组重塑(图6)。更多孔隙空间的生成促进了BRM中空气和水分传输。此外,铝土矿尾矿和赤泥含有大量原生矿物,如石英、方钠石等。本研究中,种植后在BRM中发现新次生矿物蒙脱石。种植碱蓬(S. glauca)和草木樨(M. suaveolens)显著增强了高岭石峰强度,这可能是由于BRM中高含量的硅酸盐和Al³⁺通过根系作用将风化程度较低的矿物转化为高岭石和蒙脱石所致。因此,植物加速了BRM向土壤的转化。
2.植物降低盐碱,改善营养状况
正如预期,本研究中筛选的耐盐植物在盐碱条件下生长良好,同时降低了BRM的盐碱度(图3d)。种植90天后,BRM的pH、EC和交换态Na含量显著下降(p < 0.05;图3)。元素分布图像显示,根系周围BRM颗粒表面的Na含量从11.4%降至1.19–10.3%(图4)。植物通过根系吸收Na⁺并转运至地上部,导致六种植物的地上部Na累积量达到43.6–153 mg/pot。植物地上部对Na的累积可有效缓解BRM处置区的盐渍化。此外,XRD图谱显示,种植后BRM中方钠石和钙霞石的峰值显著降低(图S4),这可能与根系分泌物中的有机酸促进这两种化学碱的溶解有关。然而,这些化学碱的溶解会释放OH⁻和Na⁺,导致BRM的pH和EC升高(图3)。EC值的波动幅度大于pH值,这可能是因为植物虽持续分泌有机酸,但盐分吸收具有间歇性,植物吸收饱和盐分后需时间调节内部稳态,如通过盐腺排出Na⁺。
已有研究表明,种植显著影响生长基质的肥力。植物生长期间,约5–25%的光合固碳会以根系分泌物形式进入根际。本研究中,种植显著提高了BRM的SOM含量(图S6)。根际酸化作用通常会增加土壤有效P和K含量,但本研究发现种植提高了BRM有效P含量却显著降低有效K(p < 0.05),这可能是因为高盐环境下植物需吸收大量K⁺维持胞内K⁺/Na⁺稳态。此外,种植草木樨(M. suaveolens)和田菁(S. cannabina)显著增加有效N含量,而种植草木樨使BRM中Rhizobium丰度提升3.42倍,表明在贫瘠的BRM环境中,这两种豆科植物仍能通过与根瘤菌共生形成根瘤(图1c),实现固氮反馈。种植还显著增强BRM的脲酶和蔗糖酶活性(p < 0.05),反映出更快的C、N周转速率。
3.植物重塑BRM中的微生物组
本研究发现,种植提高了BRM细菌和真菌的多样性与丰富度指数(图S8)。这一现象与种植增加孔隙体积和面积(表1)密切相关,更大的孔隙体积意味着资源可利用性增强,从而支持更丰富的微生物丰度。此外,更大的孔隙面积提供了更多的微生物栖息表面和活性位点,同时将厌氧环境转变为有氧环境。这些变化重塑了BRM中的细菌和真菌(图S9),且不同植物间存在差异(图S10)。例如,盐碱调控能力更强的草木樨(M. suaveolens)和碱蓬(S. glauca)显著降低了嗜盐细菌丰度,而种植青葙(C. argentea)和地肤(B. scoparia)提高了PGPR芽孢杆菌属Bacillus的丰度(图S12)。此外,部分病原微生物(如Rhizoctonia和Ralstonia)丰度在种植后显著下降,这些微生物是引发多种植物病害的重要病原体。植物在逆境中可招募保护性微生物并增强其活性以抑制根际病原菌。本研究还发现,种植显著增加了微生物网络的复杂性和稳定性(表2)。网络结构的变化改变了微生物网络中个体成员的功能,关键物种(高度连接的微生物类群)的变动会显著影响微生物组成与功能。种植不同植物导致微生物网络的关键物种不同(图5):草木樨和田菁(S. cannabina)种植的BRM中关键物种为Mesorhizobium和Nitrosospira,青葙种植的BRM中关键物种为Bacillus。特别地,青葙种植BRM中有效P含量增加17.3倍(图S6)可能与Bacillus的溶磷作用有关。这些结果表明,不同植物对BRM微生物发展的促进方向存在差异。
4.适用于BRM处置区域的植被恢复战略
良好的生长状况是先锋植物适合在BRM处置区进行植被重建的首要条件。本研究中,六种耐盐碱贫瘠植物在BRM上均生长良好且未出现明显胁迫症状(图S1)。然而,由于生理特性与耐性程度差异,六种植物的生长状态不同(图S1)。其中,青葙(C. argentea)不仅地上部和根系生物量最高(图1),且根系发育良好、活性强,根体积达50.3 cm³(图2)。此外,BRM中生长的青葙叶片光合色素含量和碳氮比(C/N)最高(图S2和S3)。光合色素含量反映植物光合能力,而C/N比反映营养元素利用效率。这些结果表明青葙在BRM中维持了高生长速率。相比之下,虽被广泛用于盐碱地改良的碱蓬(S. glauca)地上部生物量较高,但其在BRM中根系发育不良(根体积仅3.21 cm³),根系活性显著低于其他植物(p < 0.05)。这可能与BRM的黏土质地及Al、As、Cr等有毒元素(图S5)抑制碱蓬根系生长有关。碱蓬的丙二醛含量显著高于其他植物(p < 0.05;图S2),表明其遭受更高程度的逆境损伤。基于这些生长状态,我们初步判定青葙是BRM植被恢复最适宜的先锋植物。
此外,适宜的植被恢复策略应有利于处置区生态功能的恢复。本研究中六种植物中,青葙(C. argentea)显著改善BRM孔隙结构,碱蓬(S. glauca)和草木樨(M. suaveolens)对盐碱度调控能力突出,而苏丹草(S. sudanense)更利于微生物组发展(图7a)。已有研究表明,具有生态位互补性的多物种恢复策略可加速生态修复进程。青葙为株高55.4 cm的阳生植物,而草木樨为株高23.9 cm的阴生植物,二者在空间上不存在竞争性。更重要的是,青葙使BRM有效磷含量显著提升,草木樨则增加有效氮含量(p < 0.05,图S6),二者的协同定殖可快速改善BRM养分状况(图7b)。从生活史特征看,青葙为一年生草本,草木樨为二年生或一年生,冬季枯萎后可为BRM输入大量有机质,利于后续物种定殖。同时,这些先锋植物难以形成单一优势种,可避免生物结构简化导致的抗性稳定性低。因此,青葙与草木樨组合种植是BRM处置区有效的植被恢复策略。需特别指出的是,BRM处置区中大量Na⁺会通过蒸发引起的毛细作用向表层迁移,抑制新物种定殖并导致植被退化。因此,BRM更适宜在湿润、半湿润地区开展植被恢复。由于BRM土壤形成过程缓慢,本策略及后续演变仍需通过长期野外试验验证。原文链接:https://doi.org/10.1016/j.jenvman.2024.122590
‘